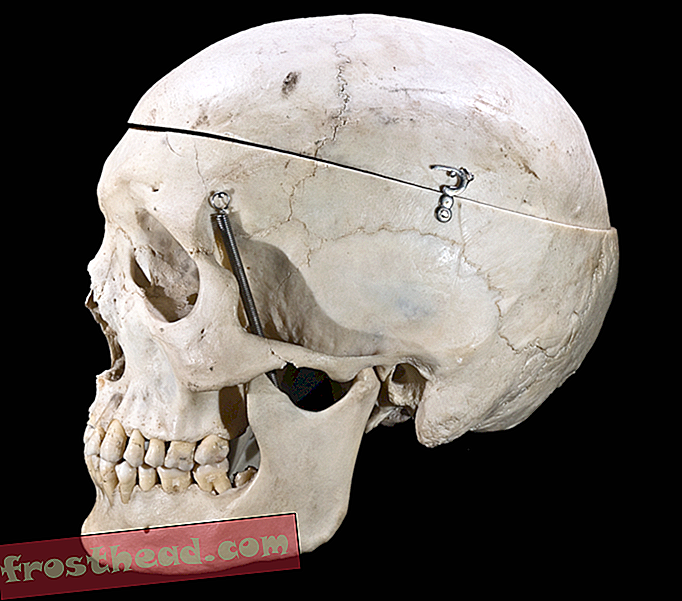
"Ravimikindlad bakterid on meie liikide jaoks üks suurimaid ohte, " ütleb etnobotaanik Mark Plotkin, Amazoni looduskaitsemeeskonna president, kes töötab koos Amazonase piirkonna inimestega metsade ja kultuuri säilitamiseks. Kaasautor Michael Shnayerson, Vanity Fair kaastöötaja, nõustub. "Inimestel pole aimugi, millised bakteriaalsed ohud ootavad neid haiglasse minnes, " ütleb ta. Uues raamatus Killers jooksul: ravimresistentsete bakterite surmav tõus, teatasid Shnayerson ja Plotkin meditsiiniuurijate tõenditele, et haigusi põhjustavate bakterite arv, mis suudavad kõige sagedamini välja kirjutatud antibiootikume tõrjuda, on märkimisväärselt kasvanud. Autorid väidavad, et me elame supervigade „sünge uue ajajärgul”, kes tsiteerib teadusuuringuid, mis viitavad sellele, et süüdistada peame ainult iseennast. Arstid, kes määravad antibiootikume, kui ravimid pole vajalikud, patsiendid, kes ei lõpeta antibiootikumiravi, ja karjakasvatajad, kes kasutavad kariloomade kasvu soodustamiseks antibiootikume, on kõik kaasa aidanud eriti vastupidavate bakteritüvede tekkele - mikroobimaailm, mis toimib vana ütluse kohaselt see, mis sind ei tapa, muudab sind tugevamaks. Teemaks on tohutu. Rahvatervise ekspertide hinnangul tapavad antibiootikumiresistentsete bakterite nakkused aastas umbes 40 000 ameeriklast. Killers jooksul tuuakse välja ekspertide pingutused probleemi ohjeldamiseks ja uute antimikroobsete ravimite väljatöötamiseks. Järgnevas väljavõttes uurivad teadlased võimsaid looduslikke aineid, mida mõned loomad nakkuse vastu eritavad - aineid, mis võivad tulevikus kaasa tuua antibiootikume.
Kui ta draakoni esimest korda jälitas, oli 1995. aasta novembris Terry Fredeking hirm. Piisavalt halb, et olla kogu lennanud Indoneesiasse, tegeleda kurikuulsalt raskete Indoneesia bürokraatidega, vapustada lämmatavat kuumust ja leida kohalik paadiomanik, kes on nõus bioloogi ja kaks kolleegi sebima üle hõredalt asustatud Komodo saare. Hullem, veel hullem, kui valetada, higiga pesta, et maailma suurim sisalik näljase meelega metsast välja tuleks. Sel esimesel korral jälgis Fredeking Komodo draakonit kitse ründamas. Komodo oli vähemalt kaheksa jalga pikk ja kaalus üle 200 naela. See nägi välja nagu dinosaurus, arvas Fredeking, et tõesti. See oli peaaegu kõik skaalad, tohutult suurte, kõverate hammastega suu. Üks sekund oli see ootuses, kõike muud kui nähtamatu. Järgmine oli see kohutava kitse kõhu ühe hammustusega välja rebimine. Nagu see juhtus, tilkus draakoni suust paks sülg, segunedes kitse vere ja sisikonnaga. Ah, jah, sülg, mõtles Fredeking, kui ta koos kolleegidega põõsaste juurest üles tõusis, hoides värisesid pikkadest kahvlitest pulgadest. Sülg oli põhjus, miks nad siin olid.
Õnne korral sisaldaks draakoni viskoosne, mädanev väljaheide looduslikku antibiootikumi, mis mingil sünteesitud kujul võiks võidelda multiresistentse Staphylococcus aureus'ega, mis põhjustab mõnikord surmavat veremürgitust, ja muude bakteriaalsete patogeenidega. Fredeking, geniaalne, jässakas, isehakanud Indiana Jones Texasest Hurstist, saaks vähemalt oma elu seikluse ja võimalusel annaks oma panuse loominguliste peptiidide põnevasse uude valdkonda. See peksis kindlasti Mehhikos nahkhiirte kogumist ja Prantsuse Guajaanas hiiglaslike Amazonase kaanide korjamist.
See uusim lähenemisviis antibiootikumide avastamisele jõudis suures osas hästi korraldatud laborisse Riiklikes Terviseinstituutides. Lõhnaval varajasel suvepäeval, 1986. aasta juunis, oli leebe mandriga MD ja teadlane nimega Michael Zasloff märganud oma Aafrika küünistega konnade kohta midagi otsustavalt veidrat. NIH filiaali inimgeneetika juhina uuris Zasloff konnade mune, et teada saada, mida nad saaksid talle õpetada geneetilise teabe liikumisest raku tuumast tsütoplasmasse. Ta süstiks munarakkudesse geene, siis näeks, mis juhtus. Konnadel juhtus just selleks suuri, häid mune; nende enda bioloogia polnud tema töö jaoks oluline.
Mõned laboriteadlased tapsid konnad pärast nende munade eemaldamiseks lahti lõikamist. Mitte Zasloff. Ta õmbleks nad toorelt - ta oli lastearst, mitte kirurg - ja kui piisavalt neid kogunes labori hägusesse paaki, viis ta nad salaja lähedalasuva oja juurde ja laskis nad minema. Sel konkreetsel päeval märkas Zasloff, et tankil näis selles olevat "midagi halba", sest mitu konna oli öö jooksul surnud ja pussitasid. Kuid mõned konnad, kelle peal ta opereeris, õmmeldi ja paaki tagasi visati, tundusid kenad. Miks see nii oli? Kindlasti ei olnud konnade õmblused piisavalt pingul, et takistada baktereid ja teisi mikroobide tungimist nende verevooludesse. Kuid nakatumist ei toimunud. Põletikku pole ka.
See oli, nagu Zasloff hiljem ütles, tema “eureka” hetk, sest isegi kui ta endale küsimuse esitas, mõistis ta vastust: ellujäänud konnad peavad olema genereerinud mingi aine, mis andis neile loomuliku antibiootikumikaitse. (Zasloff ei saanud kunagi aru, miks surnud konnad pole sedasama teinud, kuid ta arvas, et nende immuunsussüsteemid on nende päästmiseks liiga ohustatud.) Mikroskoobi alla ei ilmunud tõenäoliselt ühtegi kahtlustatavat, nii et Zasloff asus konna nahaproove jahvatama. ja selle elementide isoleerimine. Kahe kuu pärast ei suutnud ta ikkagi näha, mis ta pärast oli. Ta oskas seda siiski tuvastada selle tegevuse järgi. Ta tegeles kahte tüüpi lühikeste aminohapete ahelatega, mida nimetatakse peptiidideks - nagu valgud, kuid väiksemad. Teadlased teadsid, et peptiidid osalesid elusorganismide paljudes metaboolsetes funktsioonides kas hormoonide või muude ühenditena. Nad ei teadnud, mida Zasloff just aru sai: et mõned konnades peptiidid toimisid antibiootikumidena. Zasloff pani neile nimeks ajakirjad - heebreakeelne sõna “kilbid” - ja teoreetiliselt võisid nad viia täiesti uue inimtervishoius kasutatavate antibiootikumide klassi. Nii paljutõotav oli Zasloffi tõdemus, et kui see aasta hiljem avaldati, pühendas New York Times sellele juhtkirja, võrdles Zasloffi Alexander Fleminguga, kes on Pencillium'i nime kandva seene antibiootiliste omaduste avastanud britt . "Kui ainult osa nende laborilubadusest täidetakse, " otsustas Times oma peptiididest: "Dr. Zasloff on tootnud penitsilliini trahvi järglase. ”
Nagu Fleming, oli ka Zasloff avastanud serendipity kaudu. See oli vahend omapäraseks muutumiseks. Varsti hakkab genoomika muutma ravimite avastamist kiireks ja süstemaatiliseks otsinguks, kasutades kaasaegseid vahendeid, mis analüüsisid bakterite DNA-d - serendipity iseärasust. Kuid üksikute geenide sihtimine määratluse järgi annaks kitsa toimespektriga ravimeid. Ükski arst ei soovinud tugineda eranditult kitsa toimespektriga ravimitele, eriti tundidel enne patsiendi kultuuri laboris analüüsimist. Pealegi võib ühe bakteri geeni löömiseks mõeldud ravim peagi provotseerida sihtmärki muutvat mutatsiooni. Vaja oli ka täiesti uusi laia toimespektriga antibiootikume ja parimad neist leidusid genoomika leidmisel tõenäolisemalt kui eureka-hetked, nagu Flemingi ja Zasloffi oma, kui teistsugune lähenemine näitas end nii äkki ja selgelt kui uks uus tuba. Praeguseks oli mullabakteritest või seentest leitud praktiliselt kõiki antibiootikume, millel on ükskõik milline alus. Inimeste antibiootikumide väljavaade loomsetest ainetest viitas tõepoolest väga suurele ruumile.
Maailm oli palju muutunud pärast seda, kui Fleming oli avaldanud oma tähelepanekud Penicillium'i seene kohta, unustades selle siis enam kui kümneks aastaks. Nüüd otsisid biotehnoloogia riskikapitalistid meditsiinilistes ajakirjades leide, mis võiksid olla järgmine miljardi dollarine molekul. Zasloff leiaks, et ta pandi oma NIH laborist uue aktsiaseltsi juhatusse Wall Streeti raha ja Wall Streeti ootustega, tema ajakirjad said uue nime. Ligi 100 miljonit dollarit hiljem oleks ta ühtlasi traagiline kangelane ettevaatlikust jutust väljakutsetest, millega maverick silmitsi seisis uute antibiootikumide turule toomisel.
Nende tegevust jälgides avastas Zasloff, et peptiidid, mida ta nimetavad ajakirjadeks, ei tegele bakteriaalse valgu sihtimisega, nagu teevad peaaegu kõik tänapäevased antibiootikumid, vaid torgates läbi bakteriraku membraani ja moodustades ioonkanaleid, mis lasevad veel ja muudel ainetel voolata. sisse. Need omakorda lõhkevad bakteri. See purunemine või lüüsimine toimus seetõttu, et ajakirjade laeng oli positiivselt laetud ja bakterite membraaniseintel olid negatiivselt laetud elemendid, mida nimetatakse fosfolipiidideks. Positiivselt laetud peptiidid paiknevad negatiivselt laetud rakumembraanil justkui soomustatud kesta läbistades.
Seina mulgustamise mehhanism näitas, et peptiidid võivad olla eriti kasulikud resistentsete bakterite vastu. Valke, mille vastu on pea kõik olemasolevad antibiootikumid, saab muuta või asendada. Kui bakter kogu oma membraani vahetaks, oleks suurusjärk raskem. See tundus võimatu. Ja nii palju kui Zasloff nägi, tõmmati peptiidid ainult bakteriraku seinte külge - mitte kunagi, vähemalt in vitro, normaalsete inimrakkude membraanide külge. Mis tegi neist täiusliku antibiootikumi.
Teine NIH-i teadlane võis avaldada oma avastused, nagu seda tegi Zasloff, ja asus järgmise intellektuaalse väljakutse juurde tagasi oma laboris näpistama. Kuid lastearstina, meenutades tsüstilise fibroosiga imikuid, soovis Zasloff näha peptiide kohe ravimiteks muutumas. Tema esimene samm oli helistada toidu- ja ravimiametile. "Ma olen NIH-st ja tegin just avastuse, mis kohe avaldatakse, " rääkis ta bürokraadile, kelleni ta jõudis. “Kas ma saan kedagi FDA-st, kes aitaks mul teha seda, mida pean tegema, et sellest ravimiks saada?” Selgus, et FDA-l polnud süsteemi, mis aitaks valitsuse teadlastel töötada välja ravimeid, hoides samal ajal oma valitsuse töökohti. Samuti polnud NIH-l selliseid suuniseid. (Pärast pikka aega võimaldaks agentuur teadlastel tehnoloogiasiirdest tagasihoidlikul viisil kasu saada, kuid kasvav biotehnoloogiatööstus täidetakse NIHi põgenikega, kes soovivad suuremat osa oma avastuste tuludest.) Zasloff riskis vallandamise või kohtusse kaevamisega, ta avastati lihtsalt nende kõnede väljakutsumiseks, mis hakkasid peale tema artikli avaldamist ilmuma. Kui ta vestles Merckiga, võis Bristol-Myers teda kohtusse kaevata, kuna ta oli valitsusametnik, kes oli kohustatud eelistama mitte ühtegi ettevõtet teise suhtes.
Oma tuleviku otsustas riskikapitalist Wally Steinbergi kõne. Steinberg pakkus Zasloffile tehingut, mis võimaldas tal aidata alustamisel - teda hakati nimetama Magaininiks - õpetama ja jätkama lastearstina praktiseerimist. Lühidalt öeldes sai Zasloffist geneetika ja pediaatria professor, Pennsylvania ülikooli nimelises õppetoolis ja Philadelphia lastehaiglas inimgeneetika juhataja. Väljaspool Philadelphiat endise talulinna Plymouth Meeting ettevõtte parki püstitatud Magainini jaoks töötas ta osalise tööajaga konsultandina.
See oleks pidanud olema ideaalne seadistus, unistuste elu, mis tagaks iga meditsiiniuurija kadedusest haige. Kuid kuigi Zasloff oli arvanud, et saab oma haiglas laboris peptiidide kallal töötada ja tulemusi ajakirjale edasi anda, arvasid haigla direktorid mitte. Nende sõnul peaks haigla rahastatud töö jääma haigla intellektuaalomandiks. Kui ülikool, Zasloffi uue karjääri kolmas etapp, hakkas lobisema oma osa teenitud tuludest, loobus Zasloff. Heartsick, ta astus tagasi haiglas direktori kohalt ja andis ülikoolile antud tooli tagasi. Alates 1992. aastast mängib ta kogu oma karjääri Magaininis.
Kuna peptiidid näisid töötavat peaaegu kõige vastu, otsisid Zasloff ja tema kolleegid turul seisundit, mida ravis ainult üks ravim: vähem konkurentsi, rohkem võimalusi. Nad asusid elama impetiigole, kergele nahainfektsioonile, mida iseloomustavad lööbekujulised kahjustused ja mille põhjustajaks olid nahabakterid, tavaliselt teatud streptokokid või S. aureus. Kui peptiidid toimiksid sama hästi või paremini kui Bactroban, oleks olemasolev ravi heaks kiidetud. Sealt edasi võiks Magainin proovida peptiide tõsisemate aktuaalsete nakkuste vastu, omada turul paar kasumit teenivat toodet ja nii end tõsiste vereringenakkuste jaoks üles seada.
Peptiidid purjetasid läbi esimese faasi katsed: kantud tervele nahale, need ei kahjustanud. Teises faasis näisid nad häid tulemusi 45 inimesel, kellel oli tõepoolest impetiigo. Bactrobani uuringutes osales platseebo: lihtne seep ja vesi. Magainin järgis eeskuju. Kuid kui 1993. aasta keskel koostati kolme faasi uuringute tulemused, jahmatas Zasloff. Ehkki peptiidid olid teinud sama hästi kui Bactroban, polnud kumbki toode nii hästi kui seep ja vesi! Kuidas siis Bactroban esiteks heakskiidu võitis? Zasloff ei õppinud kunagi. FDA teatas lihtsalt, et peptiidid pole suutnud Bactrobanist paremini hakkama saada. Üleeile langes Magainini aktsia 18 dollarilt 3 dollarini aktsia kohta. Kui Magainin kõndis varisemisohtlikul äärel, tõmbas Zasloff jänese mütsist välja. Või õigemini: harilik hai.
1993. aastaks olid zasloffi originaalpaberist inspireerituna kümned teised teadlased otsinud peptiide teistelt loomadelt. Nad leidsid neid peaaegu kõikjalt, kust nad otsisid - kokku 70 erinevat antibiootilist peptiidi - kõigis putukatest lehmade ja Komodo draakoniteni. Huvitaval kombel eritasid erinevad olendid peptiide erinevat tüüpi rakkudest. Paljud putukad tegid nad oma valgeverelibledesse. Hobuseraua krabis ilmusid need vereelementideks, mida nimetatakse trombotsüütideks. Konnas, nagu Zasloff oli kindlaks teinud, ilmusid need närvisüsteemi ossa, mida nimetatakse graanuliteks: konn tühjendab neid näärmeid, leidis Zasloff, kui loom on stressis või kui nahk on rebenenud. Inimeste osas osutusid nad oma peptiidideks: valgetes verelibledes, soolestikus ja eriti tsüstilise fibroosiga beebide puhul hingamisteede teatavates rakkudes, mida nimetatakse niudestatud epiteeliks. Võib-olla, arvaks Zasloff, mõne teise looma peptiidid tugevama antibiootikumi kui Aafrika küünises konna oma - piisavalt tugev, et viia investorid, kes nuhtlevad Magazinini.
Ühel päeval rääkis Zasloff Maine'is Mount Deserti merebioloogialabori teadlaste rühmale oma tavapärasest kännust peptiididest. YaleUniversiteedi meditsiinikooli professor John Forrest tõstis käe, öeldes, et veetis 19 suve suvekoera hai uurides ja, jumala poolt, kui Aafrika küünisel konnal oli peptiide, peab ka hail seda tegema. Hai oli juba pikka aega olnud Forresti eksperimentaalne loomamudel, kuna konn oli Zasloffi oma. Väikesel ja vastupidaval hail olid suured lihtsad rakud ja elundid, mis hõlbustasid uurimist. Mis kõige parem, kui Forrest tegutses hariliku hai peal, sai ta selle õmmelda ja määrdunud veepaaki tagasi visata, nagu Zasloff oma konnadega tegi. Paratamatult paranes hai ilma nakkuseta. Zasloff läks hai kõhuga koju, oodates peptiidide leidmist. Selle asemel leidis ta uut tüüpi steroidi, millel on veelgi tugevam antibakteriaalne toime - see on veel kaasasündinud immuunsussüsteemi element. Ta nimetas seda skvalamiiniks. "Hei!" Ütles ta Forrestile telefoni teel. "Saatke mulle rohkem neid hai kõhud!"
Lõpuks leidis Zasloff viisi hai skvalamiini puhastamiseks ja läks üle maksadele, sest New Hampshire'is Seatrade'i nimeline kutseline kalapüük võis Federal Expressil talle anda pool tonni nädalas. Zasloff ise laadis laadimisdokist raskeid haisevate elundite kaste ja hakkas neid siis hiiglaslikku hakklihamasinasse viilima. Puhastamisprotsess hõlmas jahvatatud maksa kuumutamist prügikastides nagu suured supikausid, skvalamiinirikka saast koorimine ülalt, seejärel saast filtreerimine kõrgtehnoloogiliste sammude abil.
Koos skvalamiinidega leidis Zasloff puhastatud gunkist teisi steroide. Ta arvas, et kokku oli rohkem kui 12 liiki. Mõlemal oli lai antibiootiline toime, kuid näis, et mõlemad on suunatud hai keha teatud tüüpi rakkudele. Skvalamiinide avastuse avaldamine oli toonud kõnesid kogu maailmast ja need aitasid Zasloffi uurimusele keskenduda. Mitmed steroidid töötasid vähivastaste ainetena nii hariliku hai kui ka inimese puhul. Üks liik takistas lümfotsüütidel isegi täita AIDSi viiruse korraldusi teha rohkem viirust.
Olles kindel, et ta on leidnud võimaluse oma ettevõtte päästa, võttis Zasloff ühendust NIH Riikliku allergia- ja nakkushaiguste instituudi direktori Anthony Fauciga ja sellisena USA kõrgeima AIDS-i vastu võitlemise ametnikuga. Fauci sõlmis Magaininiga teadusuuringute ja arendustegevuse koostöölepingu ehk CRADA ja Zasloff hakkas skvalamiinide süstimist AIDS-i nakatunud hiirtele ning koertele ja ahvidele. Skvalamiinid töötasid suurepäraselt - kuni punktini. Nad peatasid lümfotsüütide kasvu, täpselt nagu laborikatsetes. Kahjuks niipea, kui ravitud loomad said skvalamiinidega löögi, lõpetasid nad söömise ja hakkasid kaalust alla võtma.
Kuude kaupa pingutas Zasloff dilemma lahendamise nimel. Hai maksa vaatav üksildane tegelane veetis ta oma päevi koorides ja süstides AIDS-i nakatunud laboriloomadele steroide. Ükski lähenemine ei töötanud. Loomade lümfotsüütide kasv peatub, nagu ka AIDS-viiruse, kuid loomad lihtsalt ei söö. Anthony Fauci loobus lootusest: patsiendi AIDS-i nakkuse peatamise võimalus nälga suremise ajal oli ilmselgelt vastuvõetamatu. Olgu, Zasloff kuulutas lõpuks, olgu. Kõik ei olnud kadunud. "See, mida loodus on meile andnud, " on ta söögiisu vähendaja, "teatas ta oma laastatud kolleegidele."
Zasloffil oli tema vastu kaks lööki ja tema toetajate jaoks oli see üheksanda põhi. Kuid 1990ndate keskpaigaks oli kogu maailmas ilmnenud resistentsuse järsk tõus peptiidid, tema teine leid, soodsamasse valgusesse lasknud. Peptiidid tundusid endiselt kõigi bakterite poolt kasutatud uute resistentsusmehhanismide suhtes täiesti läbitungimatud. Intrigeeritult pakkus FDA välja, et laseb Magaininil peptiide veel korra proovida, seekord tõsisema aktuaalse seisundi korral kui impetiigo: nakatunud diabeetilised haavandid. Nagu FDA teadis, põhjustasid olemasolevad antibiootikumid, mida kasutati nende valulike jalgade kahjustuste vastu, selliseid kurnavaid kõrvaltoimeid, et patsiendid lõpetasid tavaliselt nende võtmise - kuigi kahjustused nakatumisel kippusid tungima lihasesse ja luu ning viisid isegi kahjustatud jäseme amputeerimiseni. . Nüüd tõusis lisaks resistentsus nende antibiootikumide suhtes. Veelgi hullem, kõige lootustandvam neist - Trovan - tõmmatakse peagi turult välja maksatoksilisuse tekitaja. Siin oli tõeline vajadus - ja turunišš -, mida peptiidid tundusid ideaalselt täitvat.
Kuna patsiendid võivad diabeetiliste haavandite tagajärjel kannatada pöördumatult, otsustas FDA, et platseebot ei vajata. Zasloffi peptiidid pidid tegema lihtsalt sama hästi või paremini kui üks võrdlusravimitest, võimas antibiootikum nimega ofloksatsiin, mis ei tulnud mitte paikse salvina, vaid suukaudsel kujul. Esimeses faasis tehtud uuringutes puhuti läbi Magainin: eelmistes uuringutes näidatud peptiidid ei kahjustanud tervete inimeste nahka. Protsessi kiirendamiseks lasi FDA Magaininil ühendada järgmised kaks faasi. Aastatel 1995–1998 värvati enam kui 50 Ameerika Ühendriikide meditsiinikeskusest umbes 1000 patsienti. Need olid väga haiged patsiendid, nende kahjustused olid valusalt valusad. Kui arstid kahjustusi peptiidilahusega neelasid, tundus enamus patsientidest paranemist.
Kuna Zasloff armus lõpptulemuste üle, tundis ta end julgustatuna, kui mitte metsikult optimistlikuna. Paiksed peptiidid ei olnud suukaudse ofloksatsiini osas edestanud, kuid nad olid seda teinud peaaegu sama hästi. Kindlasti näitasid testid, et MSI-78, nagu oli teada Magainiini uusim peptiid, oli laia ja võimsa spektriga, ei tekitanud resistentsust ega avaldanud otseseid kõrvaltoimeid. Tulemused olid piisavalt tugevad, et Smith-Kline Beecham saaks partnerina sisse logida. SKB turustaks toodet Locilexina. Nüüd oli kogu Magainini jaoks vajalik ametlik nõusolek FDA nõuandekomitee poolt.
Seitsmest eri valdkondade eksperdist koosnev toimkond kohtus 4. märtsil 1999 Marylandis Silver Springis, et veeta terve päev Locilexi teenete üle arutelul. 300-ndast publikust vaadates arvas Zasloff, et hommikune sessioon läks hästi, kuid pärastlõuna oli hoopis teine lugu.
Võib-olla serveeriti paneeli liikmetele mittesöödav lõunasöök. Võib-olla oli koosolekusaal liiga kuum või külm. Ükskõik, mis põhjusel, liikmed kohtusid kohmakas meeleolus. Üks seitsmest kuulutas, et tema arvates - mis ei põhine kliinilisel kogemusel, vaid hommikuses 30-minutilises õpetuses - pole nakatunud diabeetiliste haavandite jaoks antibiootikume vaja. “Lõika lihtsalt nakatunud kude välja ja viska prügikasti, ” kuulutas naine. Üksteise järel olid liikmed nõus. Vaekogu esimees dr William Craig ei olnud sellega selgelt nõus. Sellegipoolest toimus 7-5 hääletus narkootikumide heakskiitmata jätmise üle - otsus, mille FDA kinnitas ametlikult mõni kuu hiljem. Lõppes Michael Zasloffi 13-aastane ristisõda peptiidide kasutamiseks ravimresistentsete bakterite vastu.
Järgmise kahe aasta jooksul hakkas Zasloff ise mõtlema, kas loomsed peptiidid kunagi inimestes töötavad. Võib-olla oli tee keskenduda inimese peptiididele - neid oli leitud palju - ja proovida tugevdada kaasasündinud immuunsuse tõket inimeste nakkuste vastu võitlemisel.
Oma ettevõtte elus hoidmise meeleheitliku pakkumisega lükkas Zasloff söögiisu vähendava vahendina skvalamiini kliinilistesse uuringutesse. Ta oli tõsine. Selle võis päeva päästa Hail Mary näidend, nagu ta ütles. Kuid keegi teine ei uskunud, et ta suudab selle ära tõmmata.
2000. aasta sügisel kaotasid Zasloffi enda lavastajad usu. Teadlane, kelle avastus oli ettevõtet inspireerinud, sai konsultandiks - ta lükati välja, nagu Zasloff hiljem tunnistas - ja ettevõtte suund muutus. Viidi läbi kliinilised testid skvalamiini kui söögiisu pärssiva toimega: kraam nägi välja paljutõotav, veider, kuna tee selle kasutamiseni võis olla. Varased tulemused on näidanud, et skvalamiin on efektiivne ka munasarjavälise ja mitteväikerakkulise kopsuvähi vastu. Kuid ettevõtete pressiteadetes ei mainitud enam antibiootikume ega peptiide. Nüüdsest kasutab ettevõte genoomikat, et leida uusi sihtmärke ja uusi looduslikke aineid, näiteks hormoone kui ravimeid. Et see oleks täiesti selge, muudeti nimi Magainin nimeks Genaera.
Oma mõtisklevamatel hetkedel tunnistas Zasloff, et on teinud vigu. Kuid ta ei kahetsenud oma rolli kasvava uue valdkonna loomisel: pärast tema 1987. aasta algdokumenti on kirjutatud umbes 3000 peptiidide artiklit, umbes 500 peptiidi avastatud. Kaasasündinud immuunsussüsteem oli nüüd osa teadusest. Ja Zasloffi jaoks oli peptiidide kõige lootustandvam aspekt ikkagi nende tugevus resistentsete bakterite vastu. Nad püsisid läbi enamiku, kui mitte kogu evolutsiooniajaloo. Selle aja jooksul ei olnud bakterid kunagi nende suhtes resistentseks muutunud. Kas oli liiga palju arvata, et need moodustasid patogeenide Achilleuse kanna? Kas bakterid ei muutu kunagi peptiidide suhtes resistentseks? "Neil on olnud miljard aastat aega, et neid asju ära hoida, " sõnas Zasloff, "ja see on see, mis meil on."
Antikehade süsteemide presidendina, Texases asuvast väikesest biotehnoloogiaettevõttest Terry Fredeking oli pühendunud loomade peptiidide ja muude looduslike ainete otsimine, mida eksootilisem, seda parem, mis võib viia resistentsete patogeenide ravimite väljatöötamiseni. Michael Zasloffi avastus oli teinud tema töö võimalikuks; üks Zasloffi endistest õpilastest oli tema tööl. Mõned tema proovid - mis muu hulgas sisaldasid Tasmaania kuradite parasiite - näitasid lubadusi in vitro, kuid Fredeking nälgis rohkem. Tõsi, ta oli natuke showboater, innukas oma nime avaldama, just sellise chutzpah'ga, mis pani laboriteadlased värisema, kuid mõnikord said asjad siiski korda tehtud. "Seal peab olema midagi suuremat kui see, " ütles ta ühel päeval ühele oma konsultantidele, Texase ülikooli parasitoloogia ja immunoloogia professorile George Stewartile. "Mida saaksime teha edasi, see on ohtlik, põnev ja edendab teadust?"
“Kuidas oleks Komodo draakonitega?” Soovitas Stewart.
“Komodo draakonid?” Kajastas Fredeking. "Mis jama nad on?"
Stewart selgitas, et maailma suurim sisalik, ametlikult tuntud kui Varanus komodoensis, oli õigustatult kuulus selle poolest, et oli üks käputäis kiskjaid, kes olid piisavalt suured ja kartmatud, et inimelusid regulaarselt röövida. Tegelikult polnud inimesed kaugeltki selle suurim saagiks: teadaolevalt tõid täisealised komod 2000 naela veepühvleid maha. Leitud ainult Indoneesia saartel Komodo, Flores ja Rinca, olid draakonid mosaiiksete järeltulijad, massiivsed vee-roomajad, kes tiirutasid mered 100 miljonit aastat tagasi. Ehkki Komodo draakon jahtis sageli oma saagiks ja ta sööstis seda, oli sellel ka käsitöölisem tapmisviis, mis vihjas antibiootiliste peptiidide olemasolule. Varjatud jahimees, draakon ootas oma elupaigas sambarihirvi, krabisid söövaid makaak-ahve ja teisi imetajaid, kes siis oma mööduva röövlooma kõhu ees hambuliste lõualuudega olid nii tugevad kui krokodillil. Peaaegu alati pääsesid selle haavatud ohvrid, sest draakonid, paljud neist raskemad kui paks, kuue jala pikkune mees, võisid joosta vaid lühikeste löökidega. Kuna draakonid pidasid sageli mädanenud rümpasid, lõid nende lõuad virulentseid baktereid. 72 tunni jooksul pärast suure sisaliku hammustamist surevad loomad nende bakterite põhjustatud vereringe infektsioonidesse. Lõpuks peaks draakon vaeva nägema, et lõpuks oma sööki võtta.
Nii surmava sülje kui ka sellepärast, et draakon sõi rohkemate bakteritega teekonda, olid zooloogid kaua mõelnud, mis tegi draakonitest kõigi nende patogeenide suhtes immuunseks. Ükskõik, mis see oli, pidi draakoni hammaste evolutsioonilise veidruse tõttu olema tõesti võimas. Kuna nad olid habemenuga ja hambus nagu hai, siis olid draakoni hambad selle igemetega kaetud. Kui see oma lõualuu kinni lõi, lõikasid hambad läbi igemete. Draakoni surmav sülg pääses siis vereringesse. Komodo jäi siiski nakatumata. "Suure tõenäosusega, " lõpetas Stewart, "draakoni bakterid on oma immuunsussüsteemiga võidelnud juba miljoneid aastaid, kusjuures mõlemad pooled on aja jooksul tugevamaks muutunud, et hoida üksteist tasakaalus."
“See selleks!” Hüüatas Fredeking. "Juhi mind!"
Ligi kolm aastat möödus enne Fredekingi kasutamist ja kaks kolleegi said loa Komodo draakoni süljest proovide võtmiseks. Nii Indoneesia kui ka USA valitsused pidid petitsiooni esitama, sest draakon on ohustatud liik ja enamik 6000 allesjäänud loomast leitakse KomodoNational pargis, mis hõlmab mitut saart ja on nüüd maailmapärandi nimistus. Lõpuks, 30. novembril 1995, saabus mälestusväärne päev. Fredeking ja Cincinnati loomaaia roomajate kuraator Jon Arnett lendasid Balile, kus nad kohtusid Balil Udayiana ülikooli bioloogiaprofessori dr Putra Sastruwaniga ja Komodo draakonispetsialistiga. Jet viivitusest taastumiseks kulus kaks päeva, seejärel lendasid nad väikese Fokkeri lennukiga Indoneesia Florese saarele, mis muutis Fredekingi närvilisemaks kui väljavaade komodo draakonitega silmitsi seista.
Järgmisel päeval ületasid nad parvlaevaga Komodo poole - see oli Fredekingi jaoks veel üks segamatu kogemus, kuna parvlaev oli mitmel korral uppunud. Eemalt paistis saar udust varjul, väljaulatuvate vulkaaniliste kaljudega. Lähedalt vaadates nägi Fredeking, et tema rannajoon oli ääristatud kaljuste maastike ja liivaste lahtedega. Suur osa selle sisemusest oli kuiv, veerev savann, suurematest tipudest ülespoole olid bambusmetsad. Saar toetas mitmesuguseid suuri imetajaid, kes kõik olid imporditud inimese poolt: hirved, vesipühvlid, metssiga, makaagi ahv ja metsik hobune. Keegi ei teadnud, kuidas Komodo draakonid saarele on tulnud. Paleontoloogide arvates arenes nende perekond Aasias 25–50 miljonit aastat tagasi roomajatena, seejärel rändasid nad Austraaliasse, kui need kaks maisemassi kokku põrkasid. Kuna Indoneesia asus sel ajal Austraaliale lähemal, võisid draakonid saartele ujuda ja vohada, kasvades aja jooksul suuremaks, sest saared ei sisaldanud nende jaoks kiskjaid.
Kuumad ja higised veetsid bioloogid oma esimese öö saarel külas, mis polnud midagi muud kui bambuskodade kobar. Kohaliku riisi ja kala õhtusöögi ajal kuulsid nad lugusid draakonite metsikust. Komodos on 15 aasta jooksul pärast rahvuspargi asutamist ja arvepidamist hakanud ründama ja tapma kaheksa külaelanikku, peamiselt lapsi. Üks vana mees oli raja ääres peatunud, et uinakut teha: ta lamav vorm nägi haavatav ja kutsuv ning ka tema langes draakoni terasest lõksu lõualuude ohvriks. Teised lood, mida ei saa kontrollida, olid ringlenud sellest ajast, kui W. Douglas Burden tuli 1926. aastal Ameerika loodusloomuuseumi nimel kohale ja tegi esimese ametliku uuringu metsloomadest, jäädvustades neist 27 ja nimetades neid Komodo draakoniteks. Burden tõi New Yorki tagasi ka esimese Komodo draakoni. Ta rääkis paljude teiste seas Meriam C. Cooperile oma seikluse loo ja vallandas Hollywoodi produtsendi kujutlusvõime. Cooper muutis draakoni ahviks, lisas Fay Wray ja andis 1933. aastal maailmale King Kongi .
Järgmisel hommikul nägi Fredeking Komodo draakonil hirmunud kitse kõhtu lahti rebimas. Ta oli lühidalt kaalunud rahustite püstolite toomist saagiks, kuid haaras idee, kui sai teada, et tõenäoliselt saavad seda eakaaslased sedati. Komodod on nii kannibalistlikud, et söövad üksteist, ka oma noori. Äsja koorunud draakonid teavad bioloogilise hädavajalikkuse tõttu, et hajutavad kõrged puud viivitamatult üles ja veedavad oma esimese kahe aasta arboreaalsete olenditena, kes on kaitstud vanemate allpool asuvate lõualuude eest.
Rahustite kasutamise asemel tõusid Fredeking ja tema kohordid peidukohtadest välja pikkade kahvlike pulgade ja ühe pika krokodillide püüdmiseks mõeldud mastiga: pikendatav masti, mille otsas oli lai silmus. Nööp libises üle draakoni pea ja tõmmati tihedalt kinni. Enne kui segane olend reageerida suutis, hüppasid talle kuus meest. Cincinnati loomaaia Jon Arnett hoidis draakoni pead ja hakkas selle ümber kanaliteibi mähima. Teised mähisid teibi selle pikendatud küüniste ümber. Sama oluline on see, et rannaäär haaras draakoni võimsa saba. Fredeking jõudis pikkade Q-näpunäidete juurde, mille ta oli lohe süljes tampoonimiseks toonud. Ta vaatas draakoni raevukaid silmi ja ehmatas siis selle kolmandat silma: kollase katusel olevat “parietaalset” silma, mis toimib valgust helendava elundina. Ta imbus sülge, šokeerides, kui paks ja viskoosne see oli - nagu vaseliin. Üks proov libistati viaali, siis teine. Fredeking hakkas tundma eufooriat. See oli siis, kui ta kuulis üht teist tõelises terroris ütlemas: "Oh jumal!"
Fredeking vaatas üles ja tundis jahimehe halvavat hirmu, kes on läinud röövloomast saagiks. More than a dozen Komodo dragons were advancing from all sides. Drawn by the noisy struggle of the dragon that had been captured, the lizards had converged with the quaintly Komodian hope of eating it—along with the men around it. Panting with adrenaline, the men pushed at the dragons with their forked sticks. With their length, body mass and sheer reptilian power, the dragons easily could have pushed right up to the men and started chomping away, either at the duct-taped dragon or at the hors d'oeuvres plate of tasty human legs. But the sight of tall men with sticks seemed to confuse them. One of the park guards—an old hand at dealing with the dragons—aggressively advanced on one of the larger lizards, and pushed him away with his forked stick. For a tense minute or so, the outcome remained uncertain. Then, one by one, the dragons turned and clumped away. Fredeking took a long breath. “Man, oh man, ” he said. “What we do for science.”
On that first trip, both of Fredeking's cohorts incurred deep scratches on the insides of their calves by sitting on the dragon's back to help restrain him. They knew that the dragon's scaly skin—as scaly as chain mail—was rife with bacteria too. Within hours, they were infected and running fevers. Fredeking was running a fever too. All three took Ciprofloxacin and soon felt better. Not surprisingly, the dragon's bacteria were susceptible, given that the bugs had probably never encountered commercial antibiotics.
Koos süljelapiga tuli Fredeking draakoni veritsevatest igemetest välja vereproovid. Kiirkülmutatud vedelas lämmastikus ja hoides termostaolistes konteinerites, lennutati proovid tagasi Texasesse, kus Fredekingi teadlased tööle said. Nad loendasid Komodo süljes 62 erinevat tüüpi bakterit. Parti kõige tugevam oli Pasteurella multicida, mis on levinud paljudes koduloomades, ehkki palju vähem virulentsetes tüvedes. Samuti leidsid nad antibiootikumipeptiide koos väikese molekuliga, mis tegi bakterite tapmisel veelgi parema töö. In vitro koputas molekul välja kolm kõige halvemat bakteriaalset patogeeni: metitsilliiniresistentne S. aureus (MRSA), vankomütsiiniresistentne Enterococcus (VRE) ja E. coli 0157: H7 või Escherichia coli. Tendesee loomaaias Tennise lähedal Nashville'is Fredekingiga ühendust pidanud veterinaararst Don Gillespie muretses, et peptiidid ei pruugi inimkehas kaua püsida. Kuid ta arvas, et seda uut väikest molekuli ei suuda inimese antikehad ära tunda ja seega olla ideaalne kandidaat uue klassi antibiootikumide jaoks.
Esiteks peaksid teadlased proovima peptiide ja molekule hiirtel, seejärel merisigadel, seejärel primaatidel. Ja isegi gung ho Fredeking teadis paremini kui mingeid ennustusi teha. "Kui see paneb hiired kasvama pikki rohelisi sabasid ja ihkama inimliha, siis teame, et see pole hea, " sõnas ta. "Põhimõtteliselt võib see asi kõikjal siin raja ääres laguneda."